Vědci z University of Georgia a Georgia State University využili neaSNOM mikroskop ke zkoumání mechanismu pronikání jednotlivých tzv. obalených virů membránou hostitelské buňky v nanoměřítku. Různé typy virů mohou do hostitelské buňky vstupovat odlišně. Nejběžnějším procesem pronikání je komplexní fúze viru do buněčné membrány. Vědci při tomto experimentu prováděli přímé kvantitativní zkoumání tohoto fúzního procesu na membránovém rozhraní vir-buňka. Měření probíhalo na úrovni velikosti jednoho jediného viru pomocí nano-FTIR spektroskopie a imagingu. Komplexní studie chování virů při pronikání do buněčné membrány poskytují životně důležité informace pro vývoj antivirových terapií a zejména vakcín proti mnoha infekcím postihujících lidstvo: chřipkám, HIV, Ebola a samozřejmě proti nyní vysoce aktuálním coronavirům. Tato vědecká práce byla nedávno zveřejněna zde v PLOS ONE.
Tzv. obalené viry mají svůj genom obklopený fosfo-lipidovou obálkou (membránou), zatímco se pohybují mezi hostitelskými buňkami. Penetrace buněčné membrány obaleným virem je klíčovým krokem v procesu buněčné infekce. Konkrétně je důležité pochopit, jak obalený virus interaguje s receptory hostitelských buněk a jaké strukturální změny se vyskytují v samotné obálce během fúze membrán. Četné studie zavedly uznávaný model fúzního mechanismu mezi cílem a virovými membránami. Tento model předpokládá, že póry mohou být vytvořeny pouze tehdy, když se cílová a virová membrána podrobí fúzi membrán za účelem zprostředkování průniku vir-buňka. Nedávná pozorování však ukazují, že cílové a virové membrány se před touto fúzí protrhnou. Studie adenovirových proteinů a hostitelských buněk navíc ukázaly, že membrány hostitelských buněk mohou být po vstupu viru zničeny i bez fúze membrán. Na druhé straně, virový obal a membrána cílové hostitelské buňky mají odlišné chemické složení a zejména strukturu. Požadavky na vytvoření pórů v každé membráně jsou proto různé, takže cílové protržení hostitelské, nebo virové membrány může být také indukováno nezávisle. Stručně řečeno: mechanismus penetrace a chování membrán je stále předmětem diskusí. Důvodem je vysoká obtížnost přímého pozorování těchto jevů v nanoměřítku a zejména nutnost chemicky specifického zobrazení tohoto procesu. Vyjasnění komplexního mechanismu kolektivní fúze sloučení mezi jedním virem a hostitelskou buňkou může poskytnout užitečné informace pro návrh antivirových sloučenin.
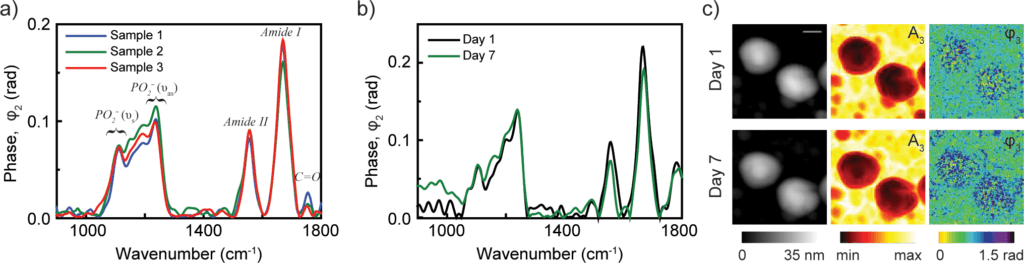
a) nano-FTIR spektra částic chřipkového viru ze tří různých vzorků při neutrálním pH (reprodukovatelnost analýzy nanočástic)
b) Spektra z virových částic odebraných 1. a 7. den, která ukazují stabilitu virových částic
c) Obrázky topografie, odrazivost a absorpci dvou částic viru chřipky v den 1 a 7
Infračervenou spektroskopií lze principiálně detekovat změny chemického a strukturního složení membrán virových a hostitelských buněk způsobené zkoumaným procesem virové infekce na molekulární úrovni. Charakteristická velikost virů, lipidových obalů a povrchových glykoproteinů zprostředkujících fúzní proces je však mnohem menší než je difrakční limit pro infračervené světlo, což brání studiu chování jednotlivých „hráčů“ infekce. Proto je důležité najít nástroj, který může poskytnout prostorové rozlišení v nanorozměrech, zatímco detekuje mechanické a chemické vlastnosti (např. absorpci infračerveného záření specifického pro molekuly). Vědci Yohannes Abate a Ming Luo použili spektroskopické infračervené nano-zobrazení poskytované mikroskopem neaSNOM ke studiu chemických a strukturálních změn, ke kterým dochází před fúzí membrány v jediném archetypálním viru chřipky X31 v různých pH prostředích. S plně kvantitativními údaji poskytnutými aplikováním nano-FTIR metodiky bylo také možné kvantitativně vyhodnotit účinnost antivirové sloučeniny (Sloučenina 136) v prevenci narušení virové membrány – tj. nový mechanismus pro inhibici vstupu viru do buňky. Mikroskopy společnosti neaspec s IR nanoimagingem a nano-FTIR spektroskopií poskytují jedinečný nástroj pro analýzu základních mechanismů, které jsou základem funkčnosti virových a buněčných membrán, v nanoměřítku, což může výrazně podpořit pokrok v základním výzkumu virů a vývoji léčby.
